3. 形態形成初期の細胞分化の誘導
予定柄細胞と予定胞子細胞の分化が集合体の形成後におこることから,これらの細胞分化がおこるためには緊密な細胞の相互作用が必要なことが容易に想像できる.この相互作用の実体を同定し,それがどのように遺伝子の発現や細胞活動をコントロールしているかを明らかにすることは,D. discoideum の発生生物学の中心的な課題で,そのために多くの研究がおこなわれてきた.発生系における細胞の相互作用は,拡散性の物質によって仲立ちされている場合や,膜蛋白質の相互作用によって情報が伝えられる場合,さらに圧力や張力のような物理的な刺激による場合など様々な形態があるが,D. discoideum の形態形成過程では拡散性の物質による細胞分化の調節がよく調べられている.そのなかで cAMP/cAMP レセプター系が形態形成期の遺伝子の発現の開始と分化形質の維持に最も重要な役割を果たし,これに細胞の運命の分岐をもたらす morphogen の DIF,さらにこれらの物質の生成や作用に影響を与えるアンモニアなどが細胞間のメッセンジャーとなって細胞分化が制御されている様子が次第に明らかになってきている.
cAMPレセプターを介した細胞分化の誘導
D. discoideumの細胞は,集合体を形成した後も cAMP の合成,分泌,そして分解をおこなう.形態形成期において重要な働きをする遺伝子の転写には,cAMPが細胞表面のレセプターに結合することが不可欠なだけでなく,予定柄細胞,予定胞子細胞の分化の安定化にも cAMP の信号が重要なことが明らかになっている.
集合(aggregation)の過程で,細胞は10ナノモル程度のパルス状の cAMP にも敏感に反応して,走化性運動と cAMP 信号のリレーをおこなうが,細胞が何層にも重なった集合体になると,細胞間の隙間は小さく,細胞が感じる cAMP の濃度はマイクロモルの領域に達すると推測されている.このような高濃度の cAMP 環境では,集合期に発現していた遺伝子の多くは抑制され,反対に形態形成期に必要な遺伝子の発現が誘導される.ここで便宜上,増殖期や集合期には必要でないが形態形成期にはその働きが不可欠な遺伝子を,形態形成期遺伝子(post-aggregative genes)とよぶことにしよう.また,予定柄細胞あるいは予定胞子細胞だけで発現する遺伝子をそれぞれpst-遺伝子(prestalk-specific genes),psp-遺伝子(prespore-specific genes),両方の細胞型で発現する形態形成期遺伝子を細胞型共通遺伝子(cell-type non-specific genes)と略記する.これらのことばを使うと,多細胞体中の高 cAMP 環境では,細胞型共通遺伝子,psp-遺伝子,pst-遺伝子が順次誘導される.分化の誘導に必要な cAMP の信号も,細胞表面のレセプターに cAMP が結合することによって細胞内に伝えられる.5-1で述べられているように,D. discoideumの cAMP レセプターには7回膜貫通型の互いによく似た4種類のものがあり,cAR1〜cAR4 と名付けられている(Rogers et al., 1997).cAR1 は cAMP に対して高い親和性を持つ(つまり感度の高い)レセプターで,集合期の cAMP 信号のリレーと走化性に主要な役割を演じている.cAR1 レセプターに続いて,やはり cAMP に対して高い親和性を持つ cAR3 レセプターも出現する.多細胞体が形成され高濃度の cAMP 環境になると,集合期の他の遺伝子とともに cAR1 遺伝子の発現も抑制されるが,cAR1 の場合には別のプロモーターからの転写が始まって形態形成期にも低いレベルで発現が続く.
さて,高濃度の cAMP によって飽和した cAR1 レセプターは,G蛋白を必要としない経路を通して一連の形態形成期遺伝子の誘導をひきおこす.最初に zink-finger を持った転写因子である G-box binding factor(GBF)が誘導される.GBFは,G-boxとよばれる形態形成期遺伝子のシス領域に結合してその遺伝子の発現を誘導する.GBFは集合期にも少し発現が見られるが,形態形成期遺伝子の誘導には高いレベルでの発現が必要で,十分な GBF の発現の無い条件では形態形成期遺伝子の発現は全く見られず,初期の集合体から先に発生が進まない(Schnitzler et al. 1994).GBF に続いて,LagC などの細胞型共通遺伝子,それに続いて cotC などの psp-遺伝子,さらに ecmA などの pst-遺伝子が次々に誘導されるが,これらの遺伝子の発現にもGBFだけでなく高濃度の cAMP が必要なことが示されている.LagC 遺伝子は形態形成期の主要な細胞接着分子である gp150 をコードしていて,これを欠く細胞ではそれ以降の形態形成期遺伝子の発現がおこらない(Dynes et al., 1994).
これらのレセプターは,一方では集合期と同様にG蛋白を介してアデニル酸シクラーゼを活性化して細胞内の cAMP 量を増やし,その結果,両予定細胞への分化に必要な cAMP 依存性プロテインキナーゼ(PKA)を活性化する.特に胞子外皮蛋白をコードするcot遺伝子群の転写はPKAの活性に完全に依存している(Hopper et al., 1993b; Mann et al., 1997).また,MAP kinaseであるERK2はACの活性化と必要で,多細胞期にその活性が無いと予定胞子細胞が分化できない(Gaskins et al., 1996; 6.3を参照)(註3).細胞外では,cAMP 信号の調節に分解酵素 phosphodiesterase が重要な働きをしている(Sucganget al., 1997).また,D. discoideumのアデニル酸シクラーゼには,ACAの他に、ACAと生化学的に区別できる ACB と,胞子の発芽の時に発現する ACG がある(Pitt et al., 1992; Kim et al., 1998; Meima and Schaap, 1999).ACB 活性はほとんど(またはすべて)acrA 遺伝子にコードされる ACR に由来し,子実体形成期に主に働いていると考えられる(Söderbom et al., 1999; 「5. 子実体形成期における分化の調節 − 分化抑制の細胞内信号伝達機構」を参照).
(註3) 予定胞子細胞の分化には転写因子と思われるpslA遺伝子も必要なことが示されているが,その発現は直接 cAMP による調節を受けていないと考えられる(Yasukawa et al., 1998).
予定胞子細胞の分化を補助する因子
上で見たように,マイクロモル程度の cAMP があれば予定胞子細胞の分化がおこるはずだが,103 cells/cm2 以下の低い細胞密度の単層培養の条件では,集合体の中のように効率よく分化しない.標準的に用いられる野生型株のNC4で特にこの傾向が強いが,単層培養の条件でも,細胞を高い密度で培養したあとの上清を加えると予定胞子細胞への分化の効率が上がることから,cAMP 以外にも分化に必要な因子があると考えられる(Kay, 1982; Yamada and Okamoto, 1990).このような因子の中で prespore-cell-inducing factor(Ψ factor)と名づけられた糖蛋白は,集合後期に転写活性がもっとも高く,100ピコモル以下の濃度域で予定胞子細胞への分化を高い効率で誘導するとともに,予定胞子細胞の細胞分裂もひき起こす(Oohata et al., 1997; Nakagawa et al., 1999).また,Gタンパクの1つ Gα4 遺伝子の欠損株や spalten とよばれるフォスファターゼ活性を持つタンパクの遺伝子の欠損株の解析からも,予定胞子細胞の分化に必要な細胞外の因子の存在が示唆されている(Hadwiger and Firtel, 1992; Aubry and Firtel, 1999).しかし,PKA を恒常的に活性化させると非常に低い細胞密度でも効率よく胞子分化がおこるので(Kay, 1989),これらの因子のあるものはPKAの活性を調節しているのかもしれない.
DIFと予定柄細胞の分化
DIF(differentiation-inducing factor)は,単層培養条件で柄細胞分化を誘導する因子として Gross, Kay らによって見いだされた(Town et al. 1976).その後,DIF の活性を担う分子が少なくとも5種類あることが示され,主要な分子種の構造や生合成・代謝の経路も明らかになっている(Morris et al. 1987, Traynor and Kay, 1991; Kay, 1998).
DIF 活性の 95 % を担う DIF-1 は,2つの塩素を含む分子量 307 のアルキルフェノンで,脂溶性が高いため細胞膜を透過しやすい(図2).DIF-1 の骨格は,脂肪酸合成と同様にC2単位がマロニル-CoA として縮合して作られると考えられ,それが順番に環状化,塩素付加,メチル化を受けて DIF-1 が完成する.一方,代謝の第1ステップは,片方の塩素が取れる反応で,DIF-1 dechlorinase が触媒する(Nayler et al., 1992).この時の反応産物(DIF-3)は柄細胞誘導活性が DIF-1 の約 4 % しかなく,ほとんど不活性化反応といってよいことから,後で述べるように予定柄細胞分化の調節に大きな役割を果たす.
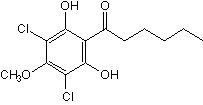
図2 DIF-1 の構造
DIF-1 は D. discoideum の増殖期には全く検出されず,多細胞体が形成される時期に細胞内の濃度が急に上昇し,突起が生じる頃にピークに達する.移動体における DIF の濃度は50〜200 nM程度と推定されている.また,集合期の細胞に cAMP をあたえると DIF の合成が誘導される(Brookman et al., 1982; 1987).DIF の作用の最も顕著なものは,その発見のきっかけとなった単層培養系での柄細胞分化の誘導である.低い細胞密度では,ナノモル以下の濃度で柄細胞分化を誘導する(Masento et al. 1988).DIF-1 がpst-遺伝子の転写を短時間で引き起こすことから,DIF-1 による柄細胞分化の誘導は直接的なものと思われる.例えば,ecmA 遺伝子の転写活性は DIF-1 を与えてから15分以内にnuclear run-off assayで検出できる(Williams et al. 1987).ほとんどのpst-遺伝子の発現が DIF-1 を必要とするほか,セルロース合成酵素のように予定柄細胞で活性の高い酵素も DIF-1 によって誘導される(Kay, 1997).逆にpsp-遺伝子の転写は DIF-1 によって阻害される(Early and Williams, 1988).また,すでに予定胞子細胞に分化した細胞も DIF によって予定柄細胞に分化転換させることができる(Kay and Jermyn, 1983).DIF をほとんどつくらない突然変異株HM44では,予定胞子細胞は分化するが予定柄細胞はまったく分化しない(Kopachik et al., 1983)(註4).DIF は柄細胞分化の誘導の他に,発生のより早い時期の細胞のcGMP合成を一時的に低下させ,cAMP に対する細胞の様々な反応に影響を及ぼす(Wurster and Kay, 1990)(註5).
(註4) DIF-1 合成の最終ステップを触媒する des-methyl-DIF-1 methyltransferase の遺伝子を破壊すると DIF-1 はまったく検出されないが,DIF-1 とは別の pst-遺伝子誘導活性があらわれ,予定柄細胞も生じる(Kay, personal comm.).
(註5) DIF は,D. mucoroides をはじめ他の細胞性粘菌の種でも作られ,同様の働きをしていると考えられる(Kay et al., 1992; van Es et al., 1994).他の生物では,カビの1種 Chaetomium のつくる Differanisole A が DIF とよく似た構造をしていて,高い濃度で単層培養の D. discoideum 細胞に与えると柄細胞分化が誘導される(Kubohara et al., 1993).
DIF-1 によるecmA遺伝子の転写や DIF-dechlorinase の合成の誘導は非常に速く,DIF-1 はステロイドホルモンやレチノイン酸のように核内のレセプターに結合して転写を制御していると思われる.DIF-1 を選択的に結合する蛋白が細胞質と核分画に見いだされており,その発現は cAMP によって誘導され,多細胞体が形成される頃に最も高くなる.DIF-1 に対する解離定数は細胞内での DIF の濃度に近い1.8 nMで,DIF-1 類似分子に対する結合の強さには,それらの柄細胞誘導活性と非常によい相関がある(Insall and Kay, 1990).これらの結果から,この DIF-1 結合活性が DIF-1 レセプターである可能性が高い.これとは別に,DIF がカルシウム貯蔵部位に働きかけ,カルシウム濃度の上昇を介して様々な反応を引き起こす経路もあることが示唆されている.細胞内の小胞膜上の Ca2+-ATPase を阻害することによって細胞質のカルシウム濃度を高くすると,ecmB 遺伝子の発現が誘導されるほか,DIF-1 によって実際に細胞質のカルシウム濃度もゆっくり上がることが示されている(Kubohara and Okamoto, 1994; Schaap et al. 1996).一方,ヒトやマウスの白血病細胞においても DIF が細胞質のカルシウム濃度を上げ,さらに抗腫瘍作用や apoptosis を示すことが見いだされている(Kubohara, 1997).
一方,pst-遺伝子のプロモーター領域内に,DIF-1 に制御される転写因子の結合部位を見つける努力も続けられている.予定柄細胞における ecmA 遺伝子の転写活性化には,ecmA プロモーター領域と ecmO プロモーター領域の両方に存在する TTGA の繰り返し配列が必要なことが示されている(Kawata et al. 1996).また,ecmB 遺伝子にはTTGAの逆転配列が2つあり,子実体形成が始まるまでこの遺伝子の転写を抑制するのに働いている(Harwood et al. 1993).この順方向および逆方向のTTGA繰り返し配列に結合してその転写の活性化と抑制をおこなう転写因子が同定され,それが動物細胞においてサイトカインや増殖因子の信号を遺伝子に伝えるSTAT(Signal Transducer and Activator of Transcription)蛋白と相同であることからDd-STATaと名付けられた(Kawata et al. 1997).Dd-STATa は,他の STAT と同様に DNA 結合ドメイン,SH2 ドメインを持ち,cAMP が cAR1 レセプターに結合すると,G蛋白を必要としない経路でC末端のチロシン残基がリン酸化されて速やかに核に移行する.移動体が形成されると,その先端部の細胞だけで核内にとどまり,ecmB の転写を抑制する(Araki et al. 1998).しかし STATa 遺伝子をこわした細胞でも ecmA の転写がおこることから,ecmA の転写活性化には TTGA 繰り返し配列に結合する別の蛋白が働いていることになる(Mohanty et al. 1999).
細胞分化におけるカルシウムとアンモニアの役割
予定柄細胞の分化にはカルシウムも関わっていることが示唆されている.小胞に蓄えられたカルシウムの量も細胞質のカルシウム濃度も,予定柄細胞の方が予定胞子細胞より顕著に高く(Maeda and Maeda, 1973; Cubitt et al., 1995),cAMP によってひきおこされるカルシウムの一過的上昇も予定柄細胞で大きい(Saran et al., 1994).さらに,細胞内の小胞膜上の Ca2+-ATPase を阻害することによって細胞質のカルシウム濃度を高くすると,ecmB 遺伝子の発現が誘導される(Kubohara and Okamoto, 1994; Schaap et al. 1996). また,DIF によって細胞内のカルシウム濃度がゆっくり上昇することから,DIF の作用の一部はカルシウムの上昇を介しているという可能性も示唆されている(註6).しかし一方,予定胞子細胞の分化にもカルシウムが必要なことが示されている(Pinter and Gross, 1995).特に,カルシウム・カルモジュリン依存性の脱リン酸化酵素であるcalcineurinの活性が予定柄・予定胞子細胞いずれにも必要である(Horn and Gross, 1996).
(註6)ヒトやマウスの白血病細胞に DIF を与えると細胞質のカルシウム濃度を上げ,さらに抗腫瘍作用やapoptosisを示すことが見いだされている(Kubohara, 1997).
一方アンモニアは,生物活動があればアミノ酸などの脱アミノ反応で生ずる普遍的な物質で,カルシウムと同様に DIF のような特化した分化調節物質ではないが,細胞の分化や運動に大きな影響を及ぼす.細胞性粘菌の発生過程は飢餓条件下にあり,すべてのエネルギーを自分の体を構成する蛋白質や RNA を代謝することによって得ているので,アンモニアの生成が多い.とくにエネルギー消費の多い予定柄細胞,さらに,細胞質をほとんど分解し尽くす柄細胞の分化過程で多くのアンモニアが発生する(Gregg et al., 1954; Walsh and Wright, 1978; Cotter et al. 1992).
アンモニアは,後で述べるように PKA の活性を抑制し,子実体形成の制御に重要な役割を果たすが,低い濃度域では予定柄細胞への分化を抑制し,予定胞子細胞への分化を促進する(Gross et al. 1981; Bradbury and Gross, 1989; So and Weeks, 1992).プロピオン酸などの弱酸やプロトンポンプの阻害剤が,アンモニアなどの弱塩基とは反対に予定柄細胞の分化を促進することから,アンモニアは細胞質あるいは酸性小胞内の pH を上げることによって細胞分化に影響を与えていると思われる(Gross et al., 1988).弱塩基性の細胞質 pH(約7.4)は主にプロトンATPaseによって維持されているが,このプロトンポンプ活性は予定柄細胞で低く,わずかな酸負荷で pH が下がりやすい(Inouye, 1988a).しかし,予定胞子細胞の分化,特に cot 遺伝子群の発現は完全にPKAの活性に依存しているだけでなく,ecmA の発現は PKA の触媒サブユニットを欠く細胞でもおこすことができることから(Mann et al., 1997),分化に対するアンモニアの影響はPKAの活性化の抑制とは異なる経路によると考えられる.また,DIF-1 による pst-遺伝子の誘導がアンモニアなどの弱塩基によって抑制され,弱酸で促進されるのに対し,psp-遺伝子の発現はこれらの影響を受けない(Wang et al., 1990; van Lookeren Campagne et al., 1989).このように,アンモニアは DIF に拮抗することによって分化の比率に影響を与えていると思われるが,その機構はわかっていない.
分化状態の安定化
移動体の中での DIF の分布は一見なぞめいている.はじめ DIF の濃度は予定柄領域で高いのではないかと思われていたが,実際に多数の移動体の予定柄領域と予定胞子領域をから DIF を抽出して比活性を測定すると,予定胞子領域には予定柄領域より2倍ほど高い濃度の DIF があることがわかった(Brookman et al. 1987).その後 DIF-1 を分解する酵素である DIF-1 dechlorinase が予定柄細胞のみで発現し(Kay et al. 1993),一方 DIF-1 合成酵素の des-methyl-DIF-1 methyltransferase 活性が予定胞子細胞に局在することがあきらかになって(Kay, pers.comm.),この DIF 活性の勾配は,予定胞子細胞が DIF-1 の source,予定柄細胞が DIF-1 の sink という分布の自然な結果として理解できるようになった.
しかし,なぜ DIF-1 の濃度の低いところに予定柄細胞が存在し,高いところで予定胞子細胞が落ちついていられるのだろうか.移動体中の細胞は分化転換の能力を持っていることから,もしこれらの細胞が現在受けている信号にしたがって分化状態を決めているとすると,このような細胞の分布パターンは長続きせず,分化転換を繰り返すことになるだろう.このようなことがおこらないためには,細胞は現在の分化状態を安定にする機構を持っているはずだと考えられる.実際,予定胞子細胞は予定柄細胞に比べ DIF-1 の作用を受けにくい.単層培養の条件で予定胞子細胞から予定柄細胞への分化転換を起こすのに必要な DIF-1 の濃度は,予定柄細胞の分化を維持するのに必要な濃度の 10 倍ほどになる(井上,未発表).また,すぐ後で述べる cAR4 レセプターを欠く細胞では野生型の細胞に比べ低い濃度の DIF-1 によって psp-遺伝子の発現が抑制されるが,野生型細胞の培養上清を加えると高い濃度の DIF-1 が再び必要になることから,cAR4 レセプターからの信号を受けて予定胞子細胞での DIF-1 の作用を弱める何らかのファクターが作られていることが示唆される(Ginsburg and Kimmel, 1997).
さらに,cAMP レセプターを介した glycogen synthase kinase3(GSK3)の制御も,分化状態の安定化に寄与しているように思われる.GSK3 は,動物の発生におけるパターン形成でも非常に重要な働きをするSer/Thrキナーゼで,例えばショウジョウバエでは Wg(wingless)をリガンドとする7回膜貫通型のレセプター(Frizzled)によって負の制御を受け,β-cateninを介してengrailedの発現を調節する.また,アフリカツメガエルでは背腹軸の決定に重要な働きをしている.D. discoideumでは,多細胞体が形成されて高い cAMP 環境になると,cAR3 レセプターの分布が予定胞子細胞に限られるのに対し,cAMP に対する親和性の低い cAR2 と cAR4 の2種類の cAMP レセプターが主に予定柄細胞に順次あらわれる(Yu and Saxe, 1996).このように細胞の種類によってレセプターの割合が異なると,同じ cAMP 環境でも予定柄細胞と予定胞子細胞に対して異なる影響をあたえることになる.GSK3遺伝子(gskA)を破壊すると,予定胞子分化が抑制されるとともにecmB遺伝子の転写が強く誘導され,最終的にほとんどの細胞が柄細胞に分化する.つまりGSK3の活性化は予定胞子細胞の分化を促進し柄細胞の分化を阻害すると考えられる(Harwood et al. 1995).このGSK3の活性が予定胞子細胞に局在する cAR3 レセプターによって正の制御を受け,主に予定柄細胞にある cAR4 レセプターによって負の制御を受けるので,正のフィードバックが成り立ち,それぞれの分化状態を安定にするのに働いていると考えられる.すなわち,cAR3 レセプターに cAMP が結合するとチロシンキナーゼであるZAK1が活性化され,これがGSK3をリン酸化することによって予定胞子細胞の分化を促進する(Kim et al. 1999; Plyte et al. 1999).また,cAR4 遺伝子をこわすとpst-遺伝子の発現が抑えられpsp-遺伝子の過剰発現がおこるが,それがリチウムによって回復することから,このレセプターの作用もGSK3を介していると考えられている(Louis et al., 1994; Ginsburg and Kimmel, 1997).このことは Li+ イオンが柄細胞分化をほぼ完璧に誘導する事実 (Maeda, 1970) とよく一致している。予定柄細胞が cAR4 の作用で柄細胞になってしまわないのは,定常的なGSK3の活性が cAMP による制御とは独立に維持されているからであろう(Plyte et al. 1999).
一方,cAMP が2回加水分解されて生じるアデノシンは,cAMP の cAR1 レセプターへの結合を阻害し,予定胞子分化を抑制する.アデノシンの濃度は予定柄領域で高いと考えられ,実際 adenosine deaminase によって移動体中のアデノシン濃度を下げると,予定柄細胞から予定胞子細胞への転換がおこることから,アデノシンは予定柄細胞を安定にするのに貢献している可能性が示唆されている(Schaap and Wang, 1986).
目 次 | Back | Next
第6章第2節 井上 敬 「分化パターンの調節と形態形成」 (一部改訂)
- 出版社および編者の承諾を得て掲載 -