2. 移植、マイクロインジェクション
マウンドや移動体の切断・移植などの外科手術は,ふつう透過照明の実体顕微鏡を用いて寒天培地上でおこなう.ミリポアフィルターなどの上では無色透明な移動体などは見にくく,また,子実体形成を誘導しやすい上方からの照明も避けたい.白色のミリポアフィルターの場合,陰影をつけないとほとんど何も見えないので横からの照明が要るが,この場合は走光性をひきおこすことになる.
移植などの操作をするにはシャーレの蓋を開ける必要があるが,そうすると湿度が下がり,アンモニア濃度も減少するので,細胞に様々な影響が出る.特に移動 体の移植などの場合は,乾燥もアンモニアの低下も子実体形成を誘導する大きな 要因なので,蓋を開ける時間ができるだけ少なくなるような工夫が要る.しかし、 操作を加えるにはどうしても蓋を開けなければならないので、湿度を保った箱の 中に顕微鏡など一式を入れて作業をすると,蓋を開けた影響が少なくなる.顕微鏡は接眼レンズの部分だけが外に出るようにする. 内部の湿度を高く保つには,濡れたペーパータオルなどを内部に張り,ときどき 霧吹きで水を補給するか,60度くらいの湯を通した湿った空気を絶えず送り込む.後者の場合,保湿箱の温度が上がりすぎないように低温の水を循環する冷却装置を中に入れておく必要があ る (Buhl and MacWilliams, 1991).もちろん顕微鏡やマニピュレーターには望ましい環境ではないので,しばらく使わないときは乾燥させる.
切断
移動体の切断は,Raperによる予定運命の調節の実験に始まり,移動体断片内でのそれぞれの細胞型の分布パターンの変化 (Bonner et al., 1955),分化転換の kinetics (Sakai, 1973),など,細胞の分化状態の変化に関する実験の他,cAMP やDIFなどの移動体内での分布(Brenner, 1972; Brookman et al., 1987) を調べるのにも用いられている.このような実験では、ただ移動体を切るだけなので問題はないようにも思われるが,正確な比率で切断する必要がある場合や,多数の断片を集める場合 (DIFの場合は1つのサンプルに数千の移動体の断片が集められた) などには相当の工夫が要るだ ろう.
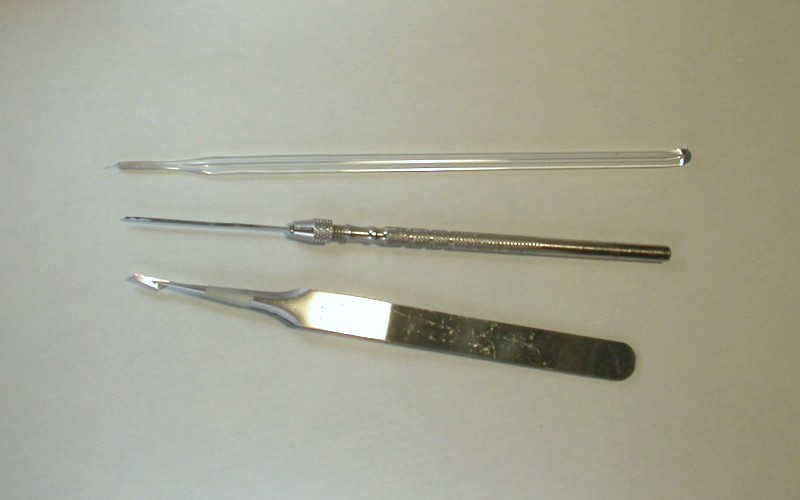
移動体などの組織の切断には様々な道具が使われている.Raperは白金・イリジ ウム合金を叩いて伸ばしたものをナイフの形に切って使ったが,細い毛髪を輪にしてガラス管などの柄に固定したもの (ヘアループ),小さく切ったアルミホイルをピンセットなどで挟んだもの,ステンレスの針をグラインダーで削ってナイフ状にしたもの,などがよく使われる.移動体などの組織をこわして混ぜ合わせるのには,ステンレスの針,細く引いたガラス棒,睫を柄の先につけたもの,などが使われている.
切断した移動体断片をつなぐのは少しむずかしく,成功率を高めるにはある程度の経験がいる.寒天表面の水分が多いと移植片がつながりにくいので、やや硬い目の寒天プレート上で移動体を形成させる.
マイクロインジェクション
ホストの移動体に比較的小さな組織片を移植するには,ホストの移植する場所の slime sheathをできるだけ取り除き,そこに移植片を埋め込めばよい.しかし, より正確におこなうには,微小なガラス針を用いてドナーから細胞を吸い出し, ホストに注入するという方法が用いられる.これには,先を細く引いたガラス管, ガラスの注射器,これらをつなぐポリエチレンなどの管,マイクロマニピュレー タ,それに,実験中に湿度を保つ工夫が必要になるが,多くの人が想像するより 簡単にできる.
マイクロインジェクションを用いるとき,注射器とガラス針の間の管を何で満た すかが問題になるが,細胞の注入のように大きな力がいるときは空気で満たすの が簡単で良い (Buhl and MacWilliams, 1991).先端の内径が20 μm程度 の細いガラス針を用いると,細胞の吸入などに0.2気圧ほどの圧力差が必要にな る.途中のラインを水などの非圧縮性の液体で満たし,ガラス管内の一部だけに 空気を残す方法では,数マイクロリットルの体積変化を注射器側で制御しなけれ ばならない.
それに対して,全部を空気で満たし、50 mlの注射筒を用いると, 注射器側では10 mlの操作をすればよいので手で十分コントロールできる.一方, 水銀粒を圧力‐体積トランスデューサーとして用いることもできる.これはきわ めて巧妙な方法で、わずかな体積のコントロールが要求される細胞内へのインジェ クションには大きな威力を発揮するが (Hiramoto, 1962; Kiehart, 1982),細胞 そのもののインジェクションのように大きな力を要する場合には、細胞自身の粘性 が圧力--体積トランスデューサーの役割をあるていど果たすので,毒物である金 属水銀をあえて用いる利点は少ない.
- ガラス針の作製
先端に小さな穴のあいたガラス針を作る.細胞 の直径は7 μmほどなので、これよりずっと小さな内径では細胞の吸入に大きな圧力 差が必要になり、細胞の損傷も大きい.実験の目的によるが内径が10〜20 μm程度が使いやすい.ガスバーナーを使って手作業でもできるが,マイクロ インジェクション用の微小電極作製器 (例えばNarishige, PC-10)を使うと効率 がよい.細いガラス管 (例えば外径1 mmのパイレックスガラス管)を微小電極作 製器で引くと,ふつう先端が閉じたガラス針ができるので,先端を注意深く折り, いくつか作ったものの中で,望ましい出来のものを選んで使う.手で折るかわり にダイアモンドペー ストと微小電極用のグラインダーを使えば,きれいな仕上がりになるが,20 μm程度にまで削るのに少し時間がかかり,先端に詰まったダイアモンドペー ストを除くのにも硫酸で洗うなどの手間が要る.
作ったガラス針は, スライドグラスの一端に両面テープを貼ったものの上に並べ,全体を例えば9 cm のプラスチックシャーレに保管するとよい.ガラス針の先端の状態を確かめるには, このスライドグラスを顕微鏡のメカニカルステージに固定して観察し,接眼マイ クロメータあるいはモニタ上で内径を測る.
- 注射器
インジェクションにはガラス製の注射筒を用いる.プラスチック製は滑らかな操 作が難しい.インジェクションの時に手にかかる力は注射筒の断面積に比例する. MacWilliamsによると,大きな注射筒ほどガラス針内の小さな圧力変化が大きく拡大されるので細かなコントロールがしやすいが,それだけ大きな力がいるので,自分で試して使いやすいものを見つけるのがよいだろう (MacWilliamsは50 mlのものを使っている).使用するガラス管と同じ外径の注射針を用意し,その先をヤスリで削ってなめら かにする.
- マニピュレータ
マニピュレータは,簡単な3軸式のもので十分だが,ガラス針を抜き差しする方 向に微動ネジが欲しい.マニピュレータは斜め下向きにセットする.
- 顕微鏡
透過照明装置のついた実体顕微鏡が使いやすいが,マニピュレータをそのままと りつけられないことが多いので何らかの工作が必要になるかもしれない.組織内 部やガラス管の中に吸い込まれた細胞がよく見えるような照明を工夫する.倒立顕 微鏡は,対物レンズの焦点深度が浅いのでガラス針の位置のコントロールがむ ずかしいが,慣れれば十分使える.倒立顕微鏡を使えば,吸入した細胞を寒天面 上にはき出し,細胞の様子を位相差で確かめるなどということができる.
- 湿度の維持
先に述べたような顕微鏡全体をおおう保湿箱を使うことになる.倒立顕微鏡を使 う場合は、倒立顕微鏡用の保 温装置があれば,それを保湿箱として使える.また,プレートの1.5倍ほどの直 径のプラスチックの円盤(大きなプラスチックシャーレの蓋の縁を落したものなど)の中心から縁までガラス管の外径より少し広い溝を切っ た蓋を作れば,保湿箱を使わずに蓋をしたままインジェクションを行なうことができ る.そのためには、もちろんホストとドナーが同じプレートにいなければならない.
- セットアップ
ガラス針と注射針をポリエチレンなどのプラスチッ ク管でつなぎ,ガラス針は支持棒につけてマニピュレータに固定する(図3). 上述の溝を切った蓋を使う場合は、普通の顕微鏡のメカ ニカルステージを実体顕微鏡のステージにとりつけるとプレートの移動がしやす い.

図3 マイクロインジェクションの装置の一例.保湿のための箱(蓋)は示していない. プレートの固定と移動のためのメカニカルステージと照明装置を古い正立顕微鏡 から流用している.実体顕微鏡は古いニコン製、マニピュレータは大昔のツァ イス製水平マニピュレータをアルミニウムのブロックで傾斜させ、鋳鉄の台に固 定している.注射筒 の大きさは50 ml.
- 操作
ガラス針の向きをマニピュレータのX--軸に正確に合わせる.ガラス針を降ろして その先端を視野の中心になるようにし,フォーカスを合わせる.マニピュレータ のX--軸だけを使ってガラス針を引き上げ,試料の入ったプレートを顕微鏡ステー ジにおき,インジェクションをおこなう対象を決めて視野のほぼ中心に持ってく る.プレートの蓋を開け,ガラス針を差し込む.溝を切った蓋を使う場合は,ガラス針が 溝を通るようにしてプレートにかぶせる.ガラス針をドナーに刺す.
注射筒を用 いて陰圧をかけ,必要なだけ細胞が吸い込まれたら手をゆるめて大気圧に戻す. マニピュレータのX--軸方向にガラス針を抜き、マニピュレータ,またはステージを動かすことでガラス針をホ ストの位置に移動する.ガラス針をホストに刺し,圧力を加えて細胞を注入する. 全部の細胞が注入される前に圧力をゆるめ,針を抜く.圧力を緩めるタイミング がおくれるとホストに多量の空気を吹き込むことになる.ガラス針を寒天のきれい なところに触れるようにして,残った細胞を吐き出す.近くのきれいな寒天にガ ラス針を少し刺して水を出し入れして洗う.
吸入を速くやりすぎるとかなりの細胞が壊れるので,丁寧に操作しなければなら ない.特に,移動体形成途中の予定胞子細胞は壊れやすい.
ガラス針は,インジェクションのあと乾燥すると詰まるので,すぐにきれいにし, 乾かないように気をつける.それでも詰まってくるので,ガラス針は 数多く用意しておくのが良い.
筆者の質問に丁寧に答えていただいたJohn Bonner 博士とHarry MacWilliams 博士に感謝します.
第2章第2節 井上 敬 「実験形態学的手法と細胞の標識」 (一部改訂)
- 出版社および編者の承諾を得て掲載 -
細胞性粘菌グループ Homepage